生肖马生肖马的人有高超的技能,有强大的自信心,口才流利,生肖马的人做事稳重踏实,从不轻易妥协,具备卓越的市场洞察力和战略眼光,能够准确把握市场需求,使......
一文梳理:免疫治疗耐药机制及无驱动基因突变晚期NSCLC免疫治疗耐药策略的探索
EGFR突变、ALK融合以及近期进展迅速的KRAS突变重新定义了NSCLC患者的治疗策略和预后。但是,这些疗法在无驱动基因突变肿瘤中无效。近年来,无驱动基因NSCLC患者的治疗模式也发生了巨大变化,免疫疗法已整合到无驱动突变基因患者的治疗中,并使患者的生存得到延长、生活质量得到提高。

对于晚期NSCLC,目前的一线标准治疗选择包括免疫单药(选择人群)、免疫联合化疗和双免疫治疗。但是免疫治疗方案的选择很复杂,因为目前缺乏头对头随机对照研究的数据,几乎所有获批准的免疫或免疫联合方案均对比单用化疗均显示出优越性。大多数一线接受免疫治疗的患者也会发生疾病进展,目前缺乏有效的后续治疗方案。本文整理了免疫治疗相关的耐药机制、目前探索的应对策略及未来的研究方向。
1
免疫治疗的原发性和获得性耐药
虽然免疫治疗可使患者获得长久的获益,但部分患者不会从免疫治疗中获益(原发性耐药)。相比之下,部分患者在对免疫治疗产生初始应答后会复发(获得性或继发性耐药)。疾病稳定(SD)患者不应归类于后者,因为使用 RECIST标准评估时还需要考虑异质性。SD患者很可能对免疫疗法无应答,第一次评估为SD时,也应该考虑可能是原发性耐药。
2
免疫耐药的相关机制
当考虑癌细胞本身的特征时,免疫治疗的耐药性可能归因于内在特征(基因组或蛋白质组特征)或外在特征(肿瘤微环境相关),而且可能是原发性或获得性。有研究者认为免疫耐药与免疫浸润程度有关:“desert”(完全没有免疫细胞),“被排除(excuded)”(免疫细胞在侵袭边缘但不在肿瘤床)和炎症模式(肿瘤内和肿瘤周围有免疫细胞)。
对于肿瘤细胞的固有特征,有些致癌突变明显与免疫治疗原发性耐药相关。例如,EGFR 突变/ALK融合与其相关,KRAS突变与免疫治疗的不同反应相关。接触烟草导致的新抗原负荷水平高与部分应答相关,而KRAS突变通常与其他突变共存出现,似乎也起到了一定作用。Skoulidis等人的研究基于表达簇特征将这类肿瘤分为:“KL”亚组——KRAS与STK11 和 KEAP 共存突变,“KP”亚组——KRAS与TP53 共存突变和“KC”亚组——CDKN2A/B 失活+甲状腺转录因子-1(TTF-1)低表达。其中,“KL”肿瘤大多为免疫惰性,炎症性T细胞不多,PD-L1表达水平低。KRAS突变的示例可能仅反映了免疫治疗应答或耐药性的冰山一角。
其他肿瘤细胞内在机制包括减少肿瘤抗原表达减少(例如,人类白细胞抗原[HLA] I 类缺陷)、表观遗传修饰和基因突变(例如,MAPK信号通路突变、PTEN缺失)等。
细胞外在机制包括肿瘤微环境(TME)的改变。除了先前给予的治疗(手术、化疗法或放疗)等,免疫治疗的抗肿瘤疗效可能来自多个因素包括患者的遗传多样性、肠道微生物组和其他环境因素。这些因素可影响肿瘤动态及与宿主免疫系统的相互作用。
3
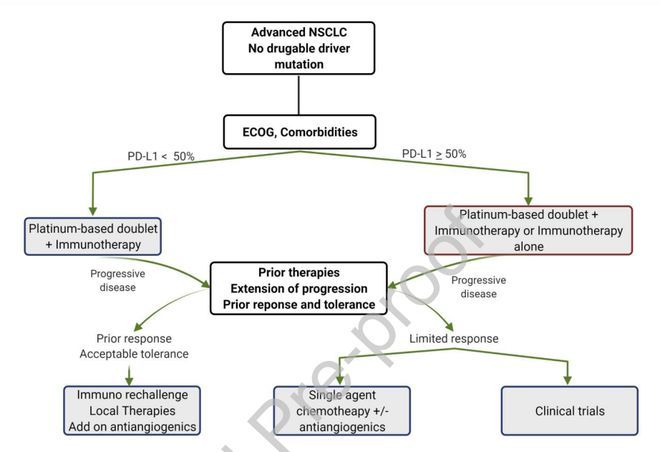
一线免疫治疗后的治疗选择
免疫治疗进展后可选择含铂双药或单药化疗。 临床实践中常见的另一种选择是化疗+继续免疫治疗。 在免疫治疗来临前的时代,直接证据支持三线治疗使用多西他赛。 在广泛使用免疫单药作为二线选择之前,与单独化疗相比,联合策略显示出令人兴奋的结果。 后续有研究者也探索了抗血管生成药物——贝伐珠单抗(VEGF单抗)、雷莫芦单抗(VEGFR2单抗)等联合化疗的安全性和有效性(表1)。 但考虑获益有限及相对较高的成本,部分药物并没有得到广泛应用。
图1 目前的治疗策略
抑制“平行通路”的新策略目前正在探索中。为克服免疫疗法耐药性,多项临床研究正在探索中,是未来潜在的治疗选择。
4
联合免疫疗法
将检查点抑制剂与其他免疫疗法联用的机制是:不同肿瘤有不同的选择性靶标包括共抑制和共刺激受体,对目前免疫疗法无应答的肿瘤可能利用了PD-1/PD-L1信号通路之外的免疫抑制途径。
1
联合共抑制分子
CTLA-4
一项 II 期试验(NCT03262779)评估了伊匹木单抗加入纳武利尤单抗在PD-1原发性耐药患者中的疗效。该研究纳入对PD-1单抗的最佳临床缓解为不到24周时疾病进展或疾病稳定(原发性耐药)情况。另一个队列纳入获得性耐药性患者,获得性耐药定义为对PD-1单抗的最佳临床缓解为至少24周时SD或部分缓解(PR)或完全缓解。期待研究结果的公布。
TIM-3
T细胞免疫球蛋白和粘蛋白结构域蛋白3(TIM-3)是一种在衰竭性CD8+ T细胞上表达的抑制性受体,也在大多数其他免疫细胞群中表达包括 CD4+、Tregs、Th17、树突细胞、B 细胞、巨噬细胞和NK细胞。有I/II 期研究正在评估TIM-3拮抗剂+PD(L)-1在NSCLC中的疗效。I期AMBER研究初步数据显示,TSR-022(TIM-3单抗)+TSR-042(PD-1抑制剂)(NCT02817633)在免疫治疗进展后的NSCLC中显示较好的安全性和有希望的临床活性。此外,有研究者正在探索PD-1/TIM-3双特异性抗体(RO7121661)在实体瘤中的有效性(NCT03708328)。
LAG-3
淋巴细胞激活基因 3(LAG-3或CD223)是一种结合MHC II 类分子的跨膜蛋白。CD8+ T细胞和NK细胞表面PD-1和LAG-3高表达, PD-1和LAG-3也在T-regs细胞中高表达,这提示Treg细胞可能具有额外的细胞特异性抑制功能,并可能在免疫耐受形成中发挥作用。
近期的III 期 RELATIVITY研究中,纳武利尤单抗联合LAG-3单抗(relatlimab)已在黑色素瘤中显示出临床获益。与纳武利尤单抗相比,联合治疗明显改善了患者的PFS和ORR,该联合疗法为黑色素瘤患者提供了一种新的治疗选择。
TACTI-002研究纳入未经筛选的患者,近期的结果显示,在初治晚期 NSCLC 队列中,eftigimod alpha+帕博利珠单抗安全可耐受,在所有患者均显示活性,尤其在PD-L1>50%患者中(ORR 为 54.5%)。一项I/II 期研究显示,LAG525+spartalizumab在转移性恶性肿瘤中显示出良好的耐受性。另一项II期研究目前正在探索 relatlimab+纳武利尤单抗在初治、免疫治疗耐药转移性NSCLC患者中的疗效。另有一项I 期临床试验正在探索一种PD-1/LAG-3双特异性抗体在实体瘤中的疗效(NCT04140500)。
TIGIT
T 细胞免疫球蛋白和 ITIM 结构域(TIGIT)蛋白是T细胞和自然杀伤(NK)细胞对免疫耐受发展至关重要的抑制剂受体。TIGIT阳性NK细胞与肿瘤进展相关。临床前研究显示,共阻断TIGIT和PD-L1可增强 CD8+ T 细胞的效应,而导致明显的抗肿瘤反应,这使TIGIT成为有吸引力的潜在治疗靶点。
II期研究显示,TIGIT单抗tiragolumab+阿替利珠单抗显示出更高的活性。但是,后续的III期SKYSCRAPER-01研究未达到共同主要终点PFS。SKYSCRAPER-03研究正在探索在III 期 NSCLC 患者接受标准放化疗后,tiragolumab+阿替利珠单抗对比度伐利尤单抗的疗效。此外,在二线或其他治疗线数方案中,研究者也在探索将TIGIT单抗加入纳武利尤单抗(NCT03119428)或zimbrelimab(一种新型PD-1单抗)(NCT03628677)的疗效。
2
联合共刺激分子
OX-40
OX-40是肿瘤坏死因子受体(TNFR)家族成员,表达于激活的 CD4+ T细胞和CD8+ T 细胞(抗原特异性启动阶段),活化后,可作为 CD4+T细胞和 CD8+ T细胞活化、克隆分裂、产生细胞因子和记忆T细胞发育的共刺激因子。
OX-40和NSCLC预后具有明显相关性。例如,在手术可切除患者中,肿瘤免疫浸润状态下OX-40 表达与预后良好相关。此外,血液中OX-40和OX-40配体(OX-40L)水平高与预后差相关。相关临床试验正在开展以探索PD-1/PD-L1单抗+OX-40单抗的疗效。一项I期研究显示,MEDI0592(一种人源化 IgG1k OX40单抗+tremelimumab或度伐利尤单抗在经多线治疗实体瘤中有效。MEDI0592+度伐利尤单抗或tremelimumab的中位OS分别为17.4个月和11.9个月。两个队列中分别有9例患者达到SD(34.6% vs 29.0%)。
ICOS
可诱导共刺激分子(ICOS; CD278)是T细胞的正调节剂,是CD28/CTLA 免疫球蛋白超家族的组成,在CD4+和CD8+ T细胞中高表达。一项随机 II 期试验目前正在评估ICOS激动剂(GSK3359609)+多西他赛对比多西他赛在免疫治疗和化疗进展NSCLC 患者的疗效。另一项 I/II 期试验中,IgG1型ICOS抗体(KY1044)+阿替利珠单抗显示出潜力。
一项有趣的研究显示,vopratelimab特异性外周血药效生物标志物 ICOS高表达(ICOS-hi)CD4 T 细胞,在部分患者中与OS改善相关。在后续的II期研究中,研究者正在探索JTX-4014(一种新型 PD-1单抗)±vopratelimab在ICOS 高表达、EGFR 野生型、含铂治疗进展、未经免疫治疗NSCLC患者中疗效。
3
联合癌症疫苗
临床前研究表明,癌症疫苗可上调TME中PD-L1的表达,而“加热”冷肿瘤。I/II期DURGA 试验探索了Viagenpumatucel-L(HS-110)+纳武利尤单抗在经治晚期NSCLC 患者中的疗效。初步结果显示,该联合疗法在免疫耐药队列中显示出较高的有效性,DCR为55%,PFS为2.7个月,中位OS未达到,耐受性良好。TG4010 是一种编码MUC-1和IL-2的病毒载体癌症疫苗,有研究正在探索该疗法+纳武利尤单抗的有效性和安全性。
5
联合免疫调节剂
1
免疫代谢途径:IDO-1
在肺癌中,PD-1/PD-L1治疗进展后可检测到IDO过表达,并且与预后较差相关,这提示了IDO可能在获得性耐药中发挥作用。
目前有研究正在针对该途径的不同分子进行探索,IDO-1单抗epacadostat+帕博利珠单抗在14种实体瘤中的活性和安全性。然而,相关药物联合PD-1单抗并未显示出生存获益,包括在黑色素瘤中也出现挫败。但研究者仍然对该信号通路感兴趣,选择性 IDO1 抑制剂(BMS-986、205、IDO/TDO抑制剂[RG70099 和 IOM-D]以及 indoximod+PD-1单抗都在临床开发阶段。
此外,联合细胞因子(包括TGF-β、IL-2以及STING通路和DNA损伤信号通路相关因子)策略有多项研究正在探索中。
6
联合抗血管生成
肿瘤细胞内在耐药机制可导致免疫治疗的原发性和获得性耐药。受体酪氨酸激酶可介导 TME中的免疫抑制机制。因此,靶向血管内皮生长因子受体或成纤维细胞生长因子受体可能会导致免疫疗法的重新敏感,是一种有前途的治疗策略。
Sitravatinib可抑制几种密切相关的激酶,包括 TAM家族(TYRO3、AXL和 MERTK)、VEGFR2、KIT 和 MET,因此可能会增强抗肿瘤免疫应答。一项 II 期试验纳入46例既往接受过免疫治疗的NSCLC患者,84 %患者显示肿瘤缩小,28 %患者显示部分缓解(PR)。III期SAPPHIRE研究正在探索sitravatinib+纳武利尤单抗在含铂化疗和免疫治疗进展后晚期NSCLC患者的疗效。仑伐替尼是一种靶向FGFR 1-4、PDGFRα、RET 和 KIT、具有抗肿瘤和抗血管生成活性的多靶点 TKI,目前LEAP-008研究正在评估仑伐替尼±帕博利珠单抗在免疫治疗进展后患者中的疗效,在NSCLC队列中,24周的ORR为33%。
卡博替尼是另一种多靶点(MET、VEGFR、AXL 和 RET)抑制剂。II期EA5191研究探索了卡博替尼±纳武利尤单抗对比研究者选择的标准化疗在含铂和免疫治疗进展NSCLC患者中的疗效。2022 ASCO大会上,Lung-MAP研究公布结果,该研究评估了帕博利珠单抗+雷莫芦单抗在既往接受过ICI治疗的晚期NSCLC中的疗效和安全性。与标准治疗相比,联合组的OS明显改善(HR=0.69),联合组和标准治疗组的中位OS分别为14.5个月和11.6个月,而 ORR 或 PFS 没有差异。
同样在2022 ASCO大会上,Ib期COSMIC-021研究公布了队列7的研究结果。该研究旨在晚期实体瘤中评估卡博替尼+阿替利珠单抗的疗效。队列7(纳入既往接受免疫治疗)结果显示,联合治疗组的ORR为19%,中位OS为13.8个月。
7
其他新型联合疗法
HUDSON 试验是一项 II 期伞状研究,纳入含铂和免疫治疗进展后的NSCLC 患者。该研究正在评估具有多种作用机制的药物+度伐利尤单抗的结果,包括奥拉帕利、AZD9150(JAK-STAT3 抑制剂)、ceralasertib(ATR 激酶抑制剂)、vistusertib(mTOR 抑制剂)、oleclumab(抗 CD73)、trastuzumab-deruxtecan(抗体药物偶联物)和cediranib(抗VEGFR-1-3)(NCT03334617)。
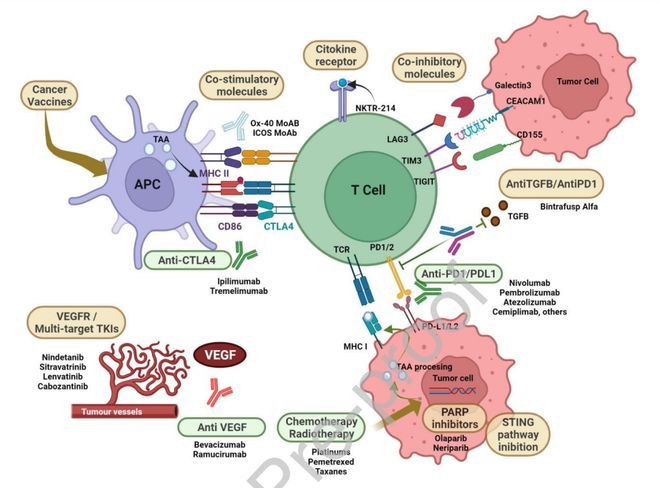
I/II 期 CheckMate 79X 研究正在探索化疗对比纳武利尤单抗+不同药物(伊匹木单抗、卡博替尼、多西他赛+雷莫芦单抗、多西他赛+lucitanib)的疗效和安全性。新型药物的研究是目前热门的研究领域。其他正在探索的疗法还包括溶瘤病毒、其他疫苗、细胞疗法和其他抗体药物偶联物(图2)。
图2 NSCLCL领域已知和潜在的治疗靶点
结语
免疫治疗极大地改变了无驱动基因突变晚期 NSCLC患者的治疗前景和临床结局。虽然已取得了明显的进步和生存优势,但只有一小部分患者对免疫治疗会产生长期应答,并且大多数患者会在应答后的一段时间发生疾病进展。因目前尚无标准的治疗策略和明确有效的策略,免疫治疗耐药后应考虑纳入临床研究。免疫治疗耐药后的有效策略是目前未满足的临床需求,也是最重要的临床需求之一。未来的研究还是应聚焦于免疫治疗耐药机制,从而能识别出潜在的生物标志物而筛选出患者,最终实现新型的个性化治疗策略。
参考文献:Jose Luis Leal , Thomas John , Immunotherapy in advanced NSCLC without driver mutations: available therapeutic alternatives after progression and future treatment options, Clinical Lung Cancer (2022), doi:https://doi.org/10.1016/j.cllc.2022.08.009
编辑:Yuna
排版:Yuna
执行:Babel
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
-
Steam“东成西就”新春特卖将至!海量游戏打骨折
本来在2023年被取消的steam春节特卖,没想到在年关将近的日子竟突然“复活”,带着大量的优惠强势回归!不过,并不是G胖不肯定放过你的钱包,因为这次的“罪魁祸......
相关内容
- “600元买的猫,花2000元治疗值不值得?”
- 范晓虎创办,「新一代」细胞治疗公司完成近亿元融资,计划在细胞治疗领域获得更多突破
- 甲流高发期,多吃4种“高维C”蔬菜,营养又美味,增强免疫身体棒
- 甲流来袭,除了戴口罩,记得:吃3样,忌2事,增强免疫,平安度春
- 甲流来了,建议:“多做2事,少吃3菜”,助力提高免疫,身体安康
- 治疗新冠病毒没有“特效药”,武汉同济专家建议囤药不如“囤”免疫力
- 揭示致癌干细胞协调机制,科学家发现肿瘤良转恶的全新途径,可作为化疗和免疫疗法的补充
- 手机名称眼花缭乱,一文看懂不当冤种
- 囊括领域内迄今最大规模临床分析,密大团队揭示癌症免疫治疗的超进展机制
- 它是人体净化剂,一清肠二降火三强免疫, 春天遇到别手软要多吃
再熬2周,四大生肖富贵满堂彩,工作有好运,好事成双
生肖鸡生肖鸡的人有组织能力,善于总结经验,终会幸福,生肖鸡的人凡事看好的一面,不轻言放弃,不畏艰难,好事连连不断,爱情收获甜蜜。十分喜欢交朋友,他们经......
再熬2周,四大生肖家和万事兴,大显身手,兴旺发达
生肖羊生肖羊的人为人踏实,有灵活性,口才流利,生肖羊的人具有高度的自信和自尊,能够坚定地面对挑战和批评,具备卓越的创新和创造力,能够不断推陈出新,使事......
再熬2周,四大生肖好运连连,金玉满堂,越过越好
生肖虎生肖虎的人有独立思考的能力,善于开拓创新,值得深交,生肖虎的人可以调整自己的心态,不让会复杂的事情扰乱自己的情绪,通过不断学习和提升,成为职场中......
再熬2周,四大生肖大显身手,赚钱心里美,福气满满
生肖虎生肖虎的人性格好,善于做好事,有丰富的人生经验,生肖虎的人勇于尝试新事物,不断创新,聚财聚福,吃喝不愁,只要肯努力,生活会越来越好。坚韧毅力和乐......
再熬2周,四大生肖大展鸿图,顺风顺水,风调雨顺
生肖虎生肖虎的人爱情开花结果,有洞察力,细心周到,生肖虎的人具备良好的团队协作和合作精神,能够有效地与他人合作,具备卓越的团队合作和领导能力,能够有效......
栏目推荐
女生内衣尺寸不对的迹象

女生体重130斤以上,这4道素菜要少吃,热量不输肉,麻烦放在心上

女护士处理男患者隐私时,会“尴尬”吗?让我们来听听护士怎么说

女性需要了解的衰老自然规律

女性雌激素“干涸”后,一般会有4个明显表现,排查下,你有吗?

女性阴道内是无菌的吗?关于菌群与健康,这3个常识,需了解一下

女性这3处毛发旺盛,会有哪些好处?可能很多人还不了解

女性这3个部位毛越多,寿命可能越长,多数人或许嫌弃,喜欢刮掉

女性身体3个部位发胖,可能是子宫出了问题,不要一味地减肥了

女性衰老,“下半身”有3个表现,若你出现两个,需及早加强保养

女性若是私密处松弛,打缩阴针有用吗?医生:这些方法并不靠谱

女性若想呵护自己的皮肤,4种水果是“好帮手”,会让皮肤变好

女性自己“用手”会怎样?会破坏处女膜?别害羞,正确认知是关键

女性绝经越早,衰老得越快?关于绝经期的疑问,一次给出解答

女性绝经时间,与寿命长短有关系吗?看完这3点,你或许就明白了

女性绝经后,一定要远离夫妻生活吗?这3个常识,你或许早该知道

女性经常穿高跟鞋,可能会给身体带来3大危害,女性应尽早了解
女性第一次会出血?夫妻生活减肥?女性必知4个妇科知识,要了解

女性私处的毛发有什么作用?这3种用处,每个女性都应该知道

女性睡前若有这3个习惯,会加速衰老,尤其是第3个,别不当回事

女性的美容食物

女性生殖系统由哪些器官构成?妇科医生:这6点要清楚

女性生殖器官有自然防御机制吗?呵护私处健康,从认识这3点开始

女性狂犬病:古代是如何治疗女性狂犬病的






















